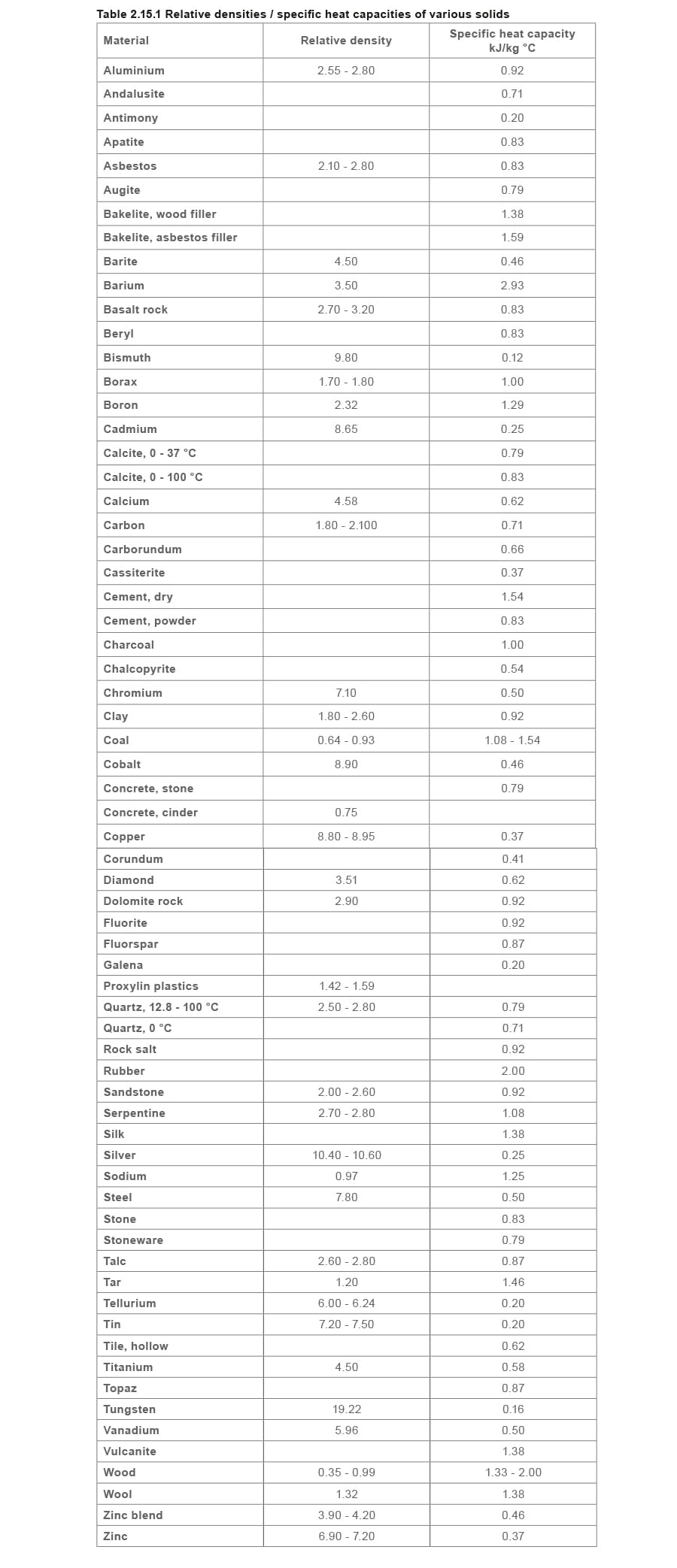
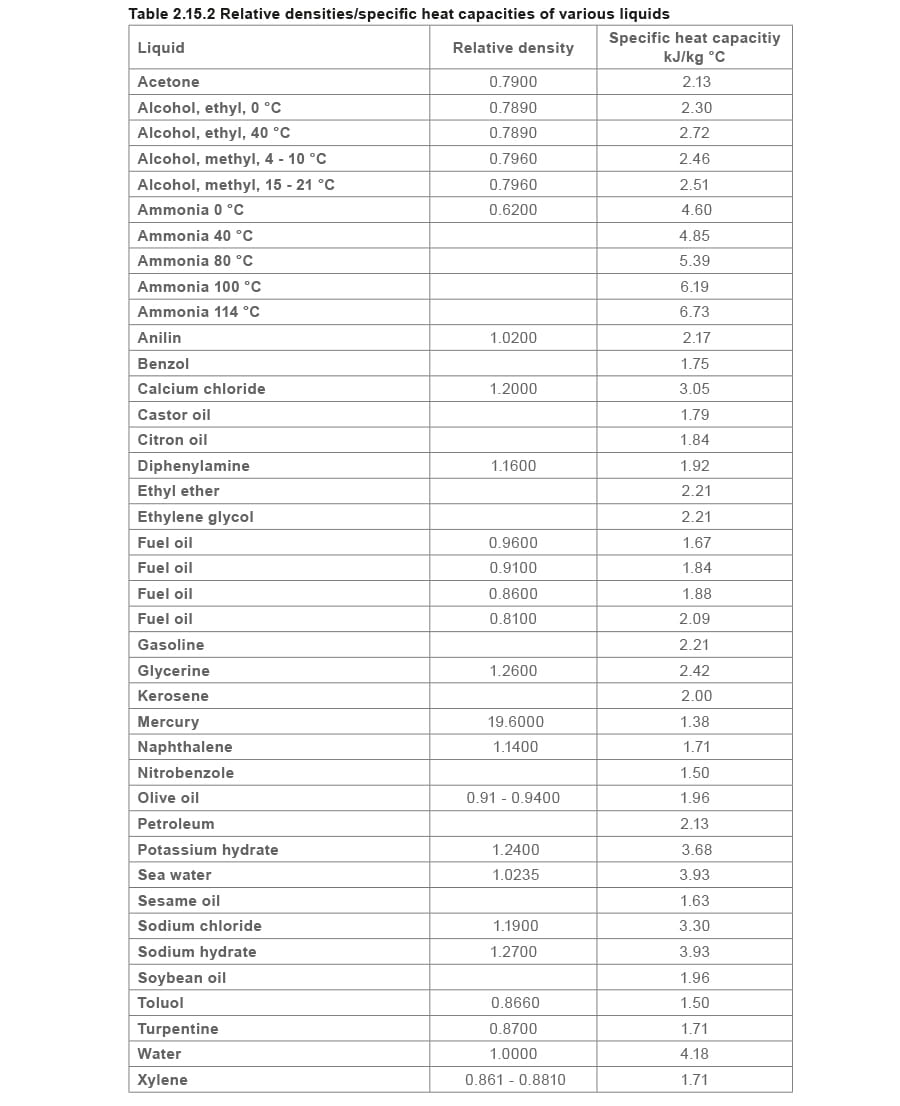
蒸汽工程原理与传热
熵 - 一个基本的理解
熵是一个很难理解的概念,但事实上它并不值得这样的恶名。把熵看作是连接热力学情况的路线图。本教程希望通过从基本原理入手,对这个主题有所了解。
什么是熵?
在某些方面,更容易说出它不是!它不是蒸汽的物质,如压力或温度或质量。传感器无法检测到它,它不会显示在仪表上。相反,它必须由可以测量的东西计算。然后可以列出熵值并用于计算;特别地,使用涡轮机或往复式发动机进行蒸汽流量的计算和电力的生产。
在某种程度上,它是能源质量或可用性缺乏的一种衡量标准,也是能源如何总是倾向于在较低温度水平下从高温源向更广阔的区域扩散的一种衡量标准。这种向外扩散的冲动使得一些观察者将熵称为“时间之箭”。如果系统的熵是在两种不同的情况下计算的,那么熵较大的情况发生在较晚的时间。随着时间的流动,整个系统的熵的增加总是以相同的方向发生。
这可能具有一些哲学兴趣,但在计算实际价值观中并不多有助于。一种更实用的方法是将熵定义为从系统中添加或从系统中移除的能量,除以变化发生的平均绝对温度。
为了了解它是如何工作的,也许最好从一个图表开始,说明一千克水在被加热到不同的压力并蒸发成蒸汽时,其焓含量是如何增加的。
由于水沸腾的温度和压力彼此固定关系,因此可以同样地绘制以显示焓抗温度,然后转动,使温度成为焓底的垂直坐标,如图2.15.2。
恒定压力线源于饱和水线。饱和水线和干燥饱和蒸汽管线之间的水平距离表示蒸发的潜热或焓的量,称为蒸发线;(蒸发焓随着压力上升而降低)。干燥饱和蒸汽管线的右侧的区域是过热的蒸汽区,并且一旦穿过干燥的饱和蒸汽管线就立即向上弯曲恒压线。
图2.15.2中的图的变化,这是非常有用的,其中水平轴不是焓,而是由焓除以焓的平均温度而被焓除以焓。为了产生这样的图,可以计算熵值。通过在大气压下温度0°C的温度下从图的来源开始,并且通过少量添加焓,可以构建图形。由于熵在绝对温度方面测量,0℃的原点温度达到273.15k。该温度下饱和水的比热是4.228 kJ / kg k。为了构建图2.15中的图表。3基础温度为273 k而不是273.15 k。
通过假设大气压下的一千克水,并通过加入4.228 kJ的能量,水温将从273k到274k增加1 k。该操作过程中的平均温度为273.5 k,见图2.15.3。

这个值表示一千克水每升高一度的焓变,称为比熵变。因此,比熵的公制单位是kJ/ kkk。
这个过程可以通过添加另外的4.228 kJ能量来继续,以在一个状态点线上产生一系列这样的点。下一阶段,温度从274 K上升到275 K,平均温度为274.5 K。
从这些简单的计算中可以看出,随着温度的升高,每一等量焓增量的熵变都略有减小。如果这个增量过程通过增加热量不断重复,就会注意到熵变会继续减小。这是由于每增加一次热量就会使温度升高,从而使代表温度的元素条的宽度减小。随着热量的增加,状态点线,也就是饱和水位线,慢慢向上弯曲。
在373.14 k(99.99°C),在大气压下达到水的沸点,并进一步添加热量在该恒温下脱掉一些水。在此位置,状态点开始在右侧的图中水平移动,并且在图2.15.4上表示,通过从饱和水线到干燥饱和蒸汽管线的水平蒸发线。因为这是一种蒸发过程,所以增加的热量被称为蒸发的焓。
图中显示了温度与熵的关系,如图2.15.4所示,其中:
- 1为饱和水线。
- 2是干燥饱和蒸汽管线。
- 3是湿蒸汽区域的恒定干燥分数线。
- 4为过热区定压线。
什么使用是温度 - 熵图(或t - s图)?
一个潜在使用T - S图在流程期间在过程中没有变化的过程期间追踪蒸汽条件的变化,在过程的初始和最终状态之间。这些过程称为势熵(恒定熵)。
不幸的是,在T - S图中显示的恒定总热线是弯曲的,这使得很难跟踪这种自由和无限制膨胀的变化,如当蒸汽被允许流经控制阀后膨胀。在控制阀的情况下,连接的上游和下游管道的速度足够接近,整个过程发生的焓不变(等焓)。在喷管的情况下,最终速度仍然很高,整个过程的熵是恒定的。
为了遵循这些不同类型的过程,可以绘制一个包含压力和温度的新图表,横轴上显示熵,纵轴上显示焓,叫做焓-熵图,或H - S图,见图2.15.5。
H - S图也被称为莫里尔图或莫里尔图,以德累斯顿的理查德·莫里尔博士命名,他在1904年首次提出了这种图的想法。
现在,蒸汽通过控制阀的等焓膨胀,只需在图的右侧用一条从初始状态到最终低压的直线表示,见图2.15.6;而蒸汽通过喷嘴的等熵膨胀只是从初始状态垂直下降到较低的最终压力的一条直线,如图2.15.7所示。
蒸汽的等熵膨胀总是伴随着焓的降低,这被称为“热降”(H)在初始和最终条件之间。H值可以简单地在Mollier图上的初始点和末点处读取,差值给出热降。这张图表的准确性对于大多数实际用途是足够的。
作为兴趣点,随着通过控制阀孔的膨胀是一个型号的工艺,假设状态点直接移动;如图2.15.6所示。事实上,它不会直接这样做。对于蒸汽通过狭窄的限制来挤压它必须加速到更高的速度。它通过将能量从焓借入并将其转化为动能来实现。这会引发热量下降。这个过程的这一部分是概要的;国家点
垂直向下移动到较低的压力。
通过狭窄的限制,蒸汽膨胀到阀出口中的较低压力区域中,并且最终随着阀体的体积增加以连接到下游管道而减速。这种速度下降需要降低动能,这主要是重新转换回热量并被蒸汽重新吸收。再生导致动能初始增加的热量降(除了由于摩擦的影响而损失的小部分),在H-S图上,状态点向上移动恒压线,直到它到达与初始条件相同的焓值。
在图2.15.8中可以看出状态点的路径,其中压力从饱和温度5巴通过例如减压阀从5巴到1巴。蒸汽在5巴的上游条件下的焓为2748 kJ / kg。
有趣的是,在上面讨论的例子中,如图2.15.8所示,蒸汽的最终状态高于饱和线,因此过热。当这种过程(通常称为节流过程)发生时,在大多数情况下,蒸汽的最终状态将比它的初始状态更干燥。这将产生干燥的饱和蒸汽或过热蒸汽,取决于初始和最终状态点的各自位置。
初始状态点和最终状态点之间的水平距离表示熵的变化。在这个例子中,虽然没有焓的整体变化(忽略摩擦的小影响),熵从约6.8 kJ/kg K增加到约7.6 kJ/kg K。
在封闭系统中熵总是增加的
在任何封闭的系统中,熵的整体变化总是积极的,即它将始终增加。值得注意的是,更详细地认为这是熵概念的基础。虽然能量总是被保守(热力学的第一定律,不能创造或摧毁能量),但对熵也不能说。热力学的第二种定律说,只要能量从一种形式交换或转换
对另一个人来说,能源的潜力越来越少。这真的是熵是什么。
这是缺乏潜在或能量质量的衡量标准;一旦能量交换或转换,它就无法恢复到更高的状态。这是最终的真理是,自然对宇宙中所有流程最终在同一温度下最终的责任,因此宇宙的熵总是增加。
例子2.15.1
考虑厨房用桌子上的茶壶,该茶壶刚刚填充一定量的含有200℃(373 k)的200kJ的热能,来自电热水壶。接下来考虑杯子周围的空气的温度在20°C,并且在该过程结束时茶壶水中的热量将是40kJ。热力学的第二种定律还指出,热量将从热身流向较冷的身体,并且在这个例子中,确定,如果留下足够的时间,茶壶将冷却到与环绕的空气相同的温度它。
整个过程的熵值变化是多少?
实用应用 - 换热器
在热交换器中,在初级侧使用饱和蒸汽在次级侧加热20℃至60℃,蒸汽将冷凝,因为它放弃了热量。这在Mollier图表中描绘了通过向初始位置的左侧移动到左侧的状态点。对于稳态条件,干燥的饱和蒸汽在恒定压力下冷凝,蒸汽状态点以恒定的压力线移动,如图2.15.9所示。
2.15.2例子
该实施例考虑在120°C的蒸汽从饱和度,蒸汽冷凝,在120°C,熵为7.13 kJ / kg k,焓约为2700 kJ / kg。可以看出,状态点从右移动到左侧,而不是水平的,而是通过沿着恒定的2个条形压力线移动。The chart is not big enough to show the whole condensing process but, if it were, it would show that the steam’s final state point would rest with an entropy of 1.53 kJ/kg K and an enthalpy of 504.8 kJ/kg, at 2 bar and 120 °C on the saturated water line.
从图2.15.9可以看出,当蒸汽凝结时,状态点向下移动蒸发线,熵降低。然而,在任何整体系统中,熵必须增加,否则侵犯了第二次热力学定律;那么如何解释这种熵减少?
至于例2.15.1中的茶壶,这种熵的减少只反映了系统的一个部分正在发生的事情。必须记住,在例2.15.2中,任何一个整体系统都包括它的周围环境,即接受蒸汽传递的热量的水。
在例2.15.2中,水接受的热量与蒸汽提供的热量完全相同(假设没有热损失),但温度比蒸汽低;所以,由于熵是由焓/温度给出的,用同样的热量除以较低的温度意味着水获得的熵大于蒸汽失去的熵。因此,系统熵的总体增加,以及能量的总体分散。